91. sayfayı gözden geçirirken aldığım özet paket buydu. Enflasyon Azaltma Yasası (IRA) maksimum adil fiyat (MFP) müzakeresine ilişkin CMS kılavuzu yaklaşık 10 gün önce yayınlandı. Aşağıda, bazı önemli bulguları özetliyorum.
FİYAT PAZARLIĞI İÇİN İLAÇ SEÇİMİ
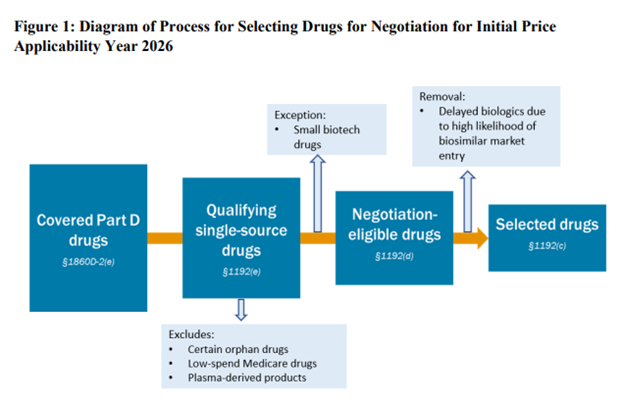
Şaşırtıcı olmayan bir şekilde, CMS, ilk IRA fiyat müzakeresine hak kazanmak için 10 ilaç arasında en yüksek maliyetli ilaçları arıyor. Spesifik olarak, FDA, 7 yıldır piyasada olan jeneriği olmayan küçük moleküllü ürünler (böylece 9. yılda pazarlık yapabilirler) veya 11 yıldır piyasada olan biyobenzerleri olmayan biyolojik ilaçlar (böylece pazarlık yapabilirler) arıyor. 13. yılda). En yüksek maliyetli ilaçlar, “Bölüm D kapsamında en yüksek Toplam Harcamaya sahip tek kaynaklı 50 nitelikli ilaç” arasında yer alan ilaçlardır. Bunlar, Kısım D reçeteli ilaç olayı (PDE) verileri kullanılarak tanımlanır.
Müzakere için uygun ilaçlar için bazı istisnalar vardır.
- Yetim ilaçlar: CMS, tüm yetim ilaçları fiyat pazarlığının dışında bırakmaz. Birçok ilacın yetim endikasyonu olmakla birlikte yetim olmayan bir hastalık için başka bir endikasyonu vardır. “CMS, FD&C Yasasının 526. bölümü uyarınca yalnızca bir nadir hastalık veya durum için ilaç olarak tanımlanan ve bu hastalık veya durum için yalnızca bir endikasyon (veya endikasyonlar) için onaylanan bir ilacı veya biyolojik ürünü hariç tutacaktır”
- Düşük maliyetli Medicare ilaçları. Medicare Bölüm B ve D harcamalarının toplamının 200 milyon dolardan az olduğu ilaçlar müzakere edilmeyecektir. Bu rakamın enflasyona endeksli olmadığını unutmayın. Zaman içinde güncellenmezse, bu hariç tutma giderek daha az ilaç için geçerli olacaktır.
- Plazma türevli ürünler. Bunlar, insan tam kanından veya plazmasından elde edilen herhangi bir ürünü içerir.
- Küçük biyoteknoloji. CMS, ilacın küçük biyoteknoloji kuralı kapsamında istisna olarak değerlendirilmesi için üreticilerden ürünleri hakkında bilgi vermelerini istiyor. İstisnaya ulaşmak için CMS, (i) üreticilerin satışlarının (PDE verilerine dayalı olarak) toplam Kısım D harcamalarının %1’inden az olmasını ve (ii) MFP için “pazarlığa uygun” olduğu değerlendirilen ilacın ≥%80’ini oluşturmasını gerektirir. Üreticinin Kısım D harcamalarından elde ettiği gelir. Bu kriterlerin her ikisi de karşılanırsa, ilaç küçük bir biyoteknoloji istisnası için uygun olacaktır.
- Biyobenzer giriş. Bir biyobenzerin üreticisi, yakında bir biyobenzer için bir yıllık bir gecikme (“İlk Gecikme Talebi”) talep edebilir. Biyobenzer üreticisi ayrıca ikinci bir ilk fiyat uygulanabilirlik yılı (“Ek Gecikme Talebi”) talep eder. Böylece, toplam potansiyel gecikme 2 yıldır. Biyobenzer üreticisi, referans ilaç (yani marka) üreticisi ile aynı şirket olamaz.
İLAÇ MÜZAKERE SÜRECİ
CMS’nin müzakerenin bir parçası olarak değerlendirebileceği bir dizi faktör vardır. Bunlar, FAMP olmayan fiyatı, seçilen ilacın karşılaştırmalı etkinliğini ve terapötik alternatiflerini içerir.
- Tıbbi ilerleme: Seçilen ilacın, seçilen ilaç için mevcut terapötik alternatiflere ve bu tür mevcut terapötik alternatiflerin maliyetlerine kıyasla terapötik bir ilerlemeyi ne ölçüde temsil ettiği;
- Terapötik alternatifler: Seçilen ilaç ve terapötik alternatifleri için FDA onaylı reçete bilgileri;
- Karşılaştırmalı etkinlik. Bu, seçilen ilacın ve terapötik alternatiflerinin belirli popülasyonlar (burada “belirli popülasyonlar” olarak anılan engelli bireyler, yaşlılar, ölümcül hastalar, çocuklar ve diğer hasta popülasyonları dahil) üzerindeki etkilerini içerir.
- Karşılanmamış tıbbi ihtiyaç. Seçilen ilacın ve ilaca terapötik alternatiflerin, tedavi veya tanının mevcut tedavi tarafından yeterince ele alınmadığı bir durum için karşılanmamış tıbbi ihtiyaçları karşılama derecesi.
CMS, müzakerenin bir parçası olarak QALY’leri kullanmayacağını açıkça belirtir ve şu bilgileri belirtir:
“Bu popülasyonlardaki bireylerin ömrünü daha düşük değerde uzatan tedaviler, örneğin kaliteye ayarlanmış yaşam yıllarının (QALY’ler) belirli kullanımları, müzakere sürecinde kullanılmayacaktır. Bir çalışmanın QALY’leri yaşam uzatma bağlamında kullandığı ancak QALY’lerin bu kullanımını rapordaki bölüm 1194’te listelenen faktörlerle ilgili diğer kanıtlardan (örn. klinik etkililik, riskler, zararlar vb.) açıkça ayırdığı durumlarda (e)(2) Yasası, CMS bu tür ayrı kanıtları değerlendirmeyi amaçlamaktadır”
CMS, aşağıdakiler dahil olmak üzere ilaç fiyatlarının belirlenmesi için çeşitli potansiyel paradigmaları değerlendirmektedir:
- Kısım D net fiyat(lar)ı ve/veya varsa seçilen ilaca yönelik terapötik alternatif(ler)in ASP(ler)i,
- Seçilen ilacın birim üretim ve dağıtım maliyeti,
- Seçilen ilaç için tavan fiyat
- Seçilen ilaç için yerel bir referans fiyat (örn. Federal Tedarik Planı fiyatı),
- Araştırma ve geliştirme maliyetlerinin karşılanıp karşılanmadığına ve birim üretim ve dağıtım maliyeti marjına dayalı olarak seçilen ilaç için “adil kar” fiyatı
Ancak şunu belirtiyorlar:
“Bu seçenekleri değerlendirdikten sonra CMS, başlangıç olarak uygun olduğu şekilde, seçilen ilaç için terapötik alternatif(ler)in D Kısmı net fiyat(lar)ını (“net fiyat(lar)”) ve/veya ASP(ler)ini kullanmayı amaçlamaktadır. Bu net fiyat veya ASP yasal tavandan yüksek olmadıkça, MFP ilk teklifini geliştirme noktası”
Devam ediyorlar:
“Seçilen ilaç için bir terapötik alternatif varsa, CMS tavandan düşükse MFP için CMS’nin ilk teklifini geliştirmek için terapötik alternatifin net fiyatını veya uygunsa ASP’yi başlangıç noktası olarak kullanmayı amaçlıyor. Birden fazla terapötik alternatif varsa, CMS, net fiyatlar ve/veya ASP’ler aralığını ve ayrıca bu aralık içindeki başlangıç noktasını belirlemek için her bir terapötik alternatifin kullanımını dikkate almayı amaçlamaktadır. Seçilen ilacın terapötik bir alternatifi yoksa, belirlenen terapötik alternatiflerin fiyatı MFP için yasal tavanın üzerindeyse (bu notun 60.2 bölümünde açıklanmıştır) veya yasal tavanın üzerinde bir fiyata sahip tek bir terapötik alternatif varsa , ardından CMS, Federal Tedarik Programı33 (FSS) veya “Dört Büyük Ajans”34 fiyatına (“Dört Büyük fiyat”) dayalı olarak ilk teklif için başlangıç noktasını belirlemeyi amaçlamaktadır.
Ancak, bu başlangıç fiyatı bir dizi faktöre göre ayarlanacaktır.
- klinik fayda. “İlk teklif için başlangıç noktası belirlendikten ve klinik faydaya ilişkin kanıtlar değerlendirildikten sonra, CMS, klinik faydanın gözden geçirilmesine dayalı olarak ilk teklif için başlangıç noktasını ayarlamayı amaçlamaktadır (bu düzeltilmiş fiyat burada, “ön fiyat”)”
- Ar-Ge maliyetleri. “Bir Birincil Üretici, araştırma ve geliştirme maliyetlerini karşılamadıysa, CMS ön maliyetleri ayarlamayı düşünebilir”
- Birim Fiyatları: “Üretim ve dağıtım birim maliyeti ön fiyattan düşükse CMS ön fiyatı aşağı, ön fiyat üretim ve dağıtım birim maliyetlerine yakınsa yukarı doğru ayarlamayı düşünebilir”
- Önceki federal destek. “İlacın keşfi ve geliştirilmesi için fon Federal kaynaklardan alındıysa, CMS ön fiyatı düşürmeyi düşünebilir”
- Patentler. “CMS, seçilen ilaç artık tek bir kaynaktan çıkmadan önce mevcut patentlerin ve münhasırlıkların uzunluğunu değerlendirmeyi amaçlamaktadır. Örneğin, seçilen ilacın birkaç yıl sürecek patentleri ve münhasırlıkları varsa, CMS ön fiyatı aşağı doğru ayarlamayı düşünebilir.
- ticari fiyatlar. “Ortalama ticari net fiyat ön fiyattan düşükse, CMS ön fiyatı aşağı doğru ayarlamayı düşünebilir”
Bir ilacın jenerik bir rakibi veya biyobenzeri olduğunda, ürün sonraki yıllarda artık MFP müzakeresine dahil edilmez.
TEKEL HÜKÜMLERİ
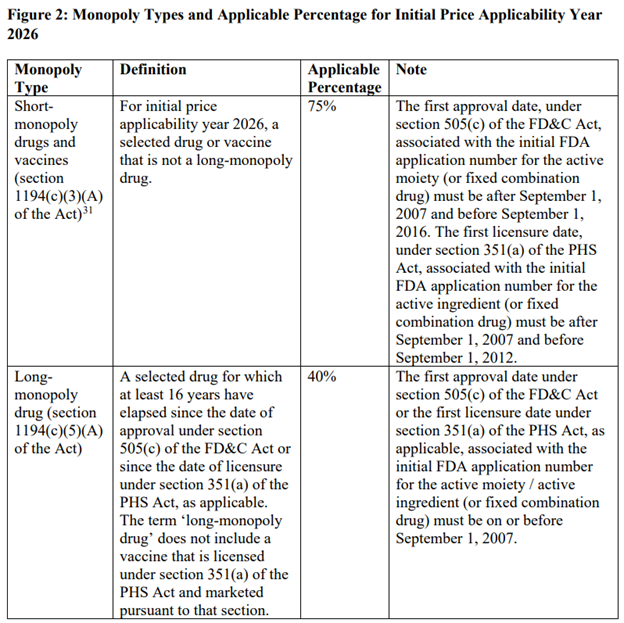
Maksimum adil fiyattan yapılan fiyat indirimleri, bir ilacın kısa vadeli (12 yıl veya daha az), uzun vadeli (16 yıldan fazla) veya arada bir yerde kabul edilmesine bağlı olarak değişir. Bu, aşağıdaki tabloda açıklanmaktadır.
İLGİLİ TARİHLER
CMS ÜRETİCİLERDEN İSTEYECEK BİLGİLER
CMS’nin IRA ilaç fiyatı müzakeresi kapsamında ilaç üreticilerinden talep ettiği bilgiler şunlardır:
- Medicare tarafından toplananın ötesindeki ilaç fiyatları
- Federal olmayan ortalama üretici (FAMP Olmayan) fiyatı: Yasanın 1194(c)(6) Bölümü, “Federal olmayan ortalama üretici fiyatını” FAMP olmayanın ortalaması olarak tanımlar (8126(h) bölümünde tanımlandığı gibi) (5) ABD Yasasının 38. başlığı) ilgili yılın dört takvim çeyreği için.
- FAMP olmayan birim: FAMP olmayan birim, US Code’un 38. başlığının 8126(h)(6) bölümünde açıklanan paket birimdir.
- Araştırma ve geliştirme (Ar-Ge):
- Temel Klinik Öncesi Araştırma Maliyetleri
- Araştırma Sonrası Yeni İlaç (IND) Başvuru Maliyetleri
- Tamamlanan ABD Gıda ve İlaç İdaresi (FDA)-Gerekli Faz IV Çalışmaları
- Terkedilmiş ve Başarısız İlaç Maliyetleri
- telafi: Seçilen İlaç için Küresel, Toplam Ömür Boyu Net Gelir. Net gelir, indirimler, ters ibrazlar ve indirimler çıkarıldıktan sonra geliri tanımlar.
- Önceki federal mali destek. Buna vergi kredileri, doğrudan mali destek, hibeler veya sözleşmeler ve seçilen ilaçla ilgili keşif, araştırma ve/veya geliştirmeyi destekleyen federal hükümet tarafından sağlanan diğer tüm fonlar dahildir.
- patent bilgisi. Süresi dolmuş ve süresi dolmamış patentler dahil olmak üzere bekleyen ve onaylanmış tüm patent başvuruları
- Pazar verileri ve satış hacmi
- Toptan edinme maliyeti (WAC) birim fiyatı
- Ortalama üretici fiyatı (AMP) birimi
- 340B fiyatları. Bunlara 340B tavan fiyatı ve 340B ana satıcı programı (PVP) fiyatı dahildir
- Diğer federal hükümet fiyatları. Bunlar şunları içerir: (i) Medicaid en iyi fiyatı, (ii) Federal tedarik programı (FSS) fiyatı ve (iii) Dört Büyük fiyatı [i.e., price for Department
of Veterans Affairs (VA), DoD, the Public Health Service, and the Coast Guard]
- ABD ticari ortalama net birim fiyatı (hasta yardım programları dahil ve olmadan)
- Üreticinin Kısım D Planı sponsorlarına ortalama net birim fiyatı (hasta yardım programları dahil ve olmadan)
- Hasılat. Buna brüt gelir, net gelir ve hasta yardım programları olmadan net gelir dahildir
CMS ayrıca üreticilerin %8,1’lik bir sermaye maliyeti üstlenmelerini gerektirir.