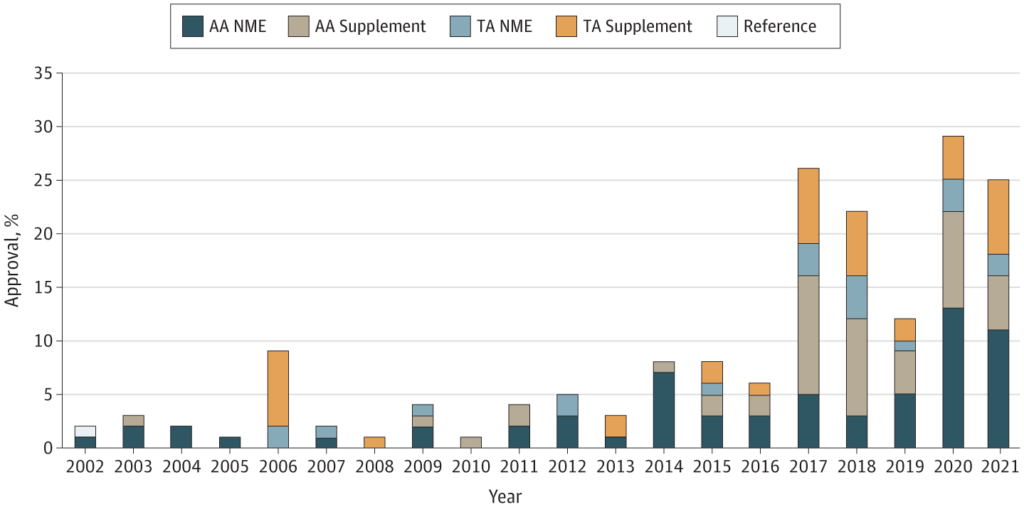
Bunlar giderek yaygınlaşıyor. Agrawal ve ark. (2022), 2002-2021 arasındaki verileri kullanmış ve FDA’nın aşağıdakileri onayladığını bulmuştur:
…116 hızlandırılmış onay (AA) ve 60 geleneksel onay dahil, tek kollu denemelere dayalı 176 yeni malign hematoloji ve onkoloji endikasyonu. Genel olarak, 87 onay (%49) yeni moleküler varlıklar veya orijinal biyolojikler içindi ve 89 onay (%51) tamamlayıcı endikasyondu. Yanıt oranı (RR), bu tek kollu denemelerde onayı desteklemek için kullanılan en yaygın son noktaydı (176’dan 173’ü). [98%]). Tek kollu denemelere dayanan 116 AA’dan 45’i (%38) klinik faydayı doğrulamak için pazarlama sonrası gereklilikleri yerine getirdi, 61’i (%52) fayda doğrulamasını bekliyor ve 10’u (%9) Aralık itibarıyla piyasadan çekildi. 31, 2021.